Перечень антигенов опухолевых клеток, против которых направлено действие вакцины РЕСАН
Вакцина РЕСАН содержит имитаторы трёх главных групп опухолевых антигенов:
1. Теломеразные - Homo sapiens telomerase reverse transcriptase (hTRT);
2. Цитокератиновые - Cytokeratin-19 (CYFRA21-1);
3. Опухольассоциированные.

Благодаря этому действие вакцины позволяет создавать иммунитет против широкого спектра опухолей.
1. Теломераза – Homo sapiens telomerase reverse transcriptase (hTRT)
Фермент теломераза активен в подавляющем большинстве человеческих опухолей и является одой из наиболее многообещающих мишеней в вакцинотерапии рака [22, 23, 24, 25]. (Этот фермент наиболее активен в отношении 85% раковых клеток) [24].
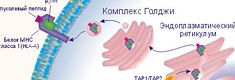
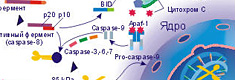
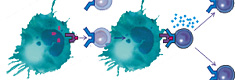
В состав вакцины входят гликопротеины, которые сходны с 22 пептидными фрагментами фермента теломеразы (hTRT). Благодаря этому вакцина обладает широким спектром противоопухолевой активности. Homo sapiens telomerase reverse transcriptase (hTRT) обеспечивает раковым клеткам способность к бесконечному делению. Фрагменты этого фермента в комплексе с молекулами HLA присутствуют на поверхности раковых клеток. Введение вакцины в организм приводит к образованию специфических противоопухолевых Т-лимфоцитов против клеток с активной теломеразой.
В аминокислотной последовательности hTRT (Табл. 1) оранжевымцветом выделены пептидные фрагменты, присутствующие в вакцине РЕСАН (использовано однобуквенное международное обозначение аминокислот).
aapsfrqvsCLKELVARVlqrlcergaknvLAFGFALLdgarggppeafttsvrsylpntvtdalr gsgawglllrrVGDDVLVHllarcalFVLVAPSCAyqvcgpplyqlGAATQARPpphasgprrrlg cerawnhsvreagvplglpapgarrrggsasrslplpkrprrgaapepertpvgqgswahpgrtrg psdrgfcvvsparpaeeatslegalSGTRHSHpsvgrqhhagppstsrpprpwdtpcppvyaetkh flyssgdKEQLRPSFLLSSLRPSLtgarrlvetiflgsrpwmpgtprrlprlpqrywqmrPLFLEL LgnhaqcpygvllkthcplrAAVTPAAgvcarekpqgsvaapeeedtdprrlvqllrqhsspwqvy gfvraclrrlvppglwgsrhnerrflrntkkfislgkhaklslqeltwkmsvrdcawlrrspgvgc vpaaehrlreeilakflhwlmsvyvvellrsffyvtettfqknrlffyrksvwsklQSIGIRQhlk rvqlrelseaevrqhrearpalltsrlrfipkpdglrpIVNMDYVvgartfrrekraerltsrvka lfsvlnyerarRPGLLGASVLglddihrawrtfvlrvraqdpppelyfvkvdvtgaydtipqdrlt eviasiikpqntycvrryavvqkaahghvrkafkshvsTLTDLQPymrqfvahlqetsplrdavvi eqssslneassglfdvflrfmchhavrirgksyvqcqgipqgsilstLLCSLCYGdmenklfagir rdglllrlvddfllvtphlthaktflrtLVRGVPEYGCVVNLRktvvnfpvedealggtafvqmpa hglfpwcgllldtrtlevqsdYSSYARTSIRASLtfnrgfkagrnmrrklfgvlrlkchslfldlq vnslqtvctnIYKILLLQAYrfhacvlqlpfhqqvwknptfflrvisdtaslcysilkaknagmsL GAKGAAgplpseavqwlchqafllkltrhrvtYVPLLGSLrtaQTQLSRKLPgttltALEAAANPA |
Специфический противоопухолевый Т-лимфоцит распознаёт на опухолевой клетке опухолевые пептиды длиной 8-10 аминокислотных остатков, представленных в комплексе с молекулой HLA класса I.
2. Цитокератины - Cytokeratin-19 (CYFRA21-1)
Злокачественная опухоль обычно имеет плотную консистенцию. Это обусловлено тем, что в раковых клетках имеется мощный клеточный скелет, называемый цитоскелетом, который состоит из белков-цитокератинов. Известно более двадцати типов цитокератинов. Во многих злокачественных эпителиальных клетках обнаружено большое количество цитокератина-19. При помощи мощного цитоскелета злокачественные клетки вытесняют нормальные, отвоёвывая новое место для своего роста у здоровых тканей.
Вакцина РЕСАН – первая противораковая вакцина, которая в своём составе содержит имитаторы белков цитоскелета злокачественных клеток. С использованием иммуноферментной тест-системы концерна Hoffmann-La Rosch CYFRA 21-1 установлено, что в одном флаконе вакцины концентрация цитокератина-19 в двадцать раз превышает концентрацию цитокератина в сыворотке крови здорового человека, что позволяет использовать вакцину для создания специфического иммунитета против различных эпителиальных опухолей человека. Присутствие имитаторов цитокератина-19 является ещё одним важным компонентом, обеспечивающим широкий спектр действия вакцины РЕСАН.
Определение цитокератина-19 используется для диагностики метастазирования злокачественных эпителиальных опухолей, т. к. клетки различных форм эпителиального рака содержат этот маркёр: рак простаты [1]; гепатоцеллюлярная карцинома [2, 3, 4]; карцинома поджелудочной железы [5, 6]; рак молочной железы [7, 8, 9]; аденокарцинома яичника [10, 11]; базально-клеточная карцинома [12]; опухоль щитовидной железы [13]; колоректальный рак [7, 14]; сквамозно-клеточная карцинома головы и шеи [7, 15]; неопластическая лимфоаденопатия [20]; карцинома лёгкого [7, 17, 18, 19, 20].
У здорового человека концентрация цитокератина-19 в сыворотке крови колеблется в пределах от 0,1 до 3,3 нг/мл, средняя концентрация цитокератина-19 составляет 2,1 нг/мл [21]. Для определения этого маркера используются иммуноферментные наборы CYFRA 21-1.
3. Опухольассоциированные антигены
Для того, чтобы усилить ответ системы иммунитета на опухолевые клетки, в состав вакцины РЕСАН входят гликопротеины, пептидные фрагменты которых сходные с фрагментами 40 наиболее распространённых опухолевых антигенов (Табл. 2).
| 1. SQUAMOUS CELL CARCINOMA ANTIGEN 1 (SCCA-1), (PROTEIN T4-A) 2. SQUAMOUS CELL CARCINOMA ANTIGEN 2 (SCCA-2) 3. Ovarian carcinoma antigen CA125 (1A1-3B) (KIAA0049) 4. MUCIN 1 (TUMOR-ASSOCIATED MUCIN), (CARCINOMA-ASSOCIATED MUCIN), (POLYMORPHIC EPITHELIAL MUCIN), (PEM),(PEMT),(EPISIALIN), (TUMOR-ASSOCIATED EPITHELIAL MEMBRANE ANTIGEN), (EMA), (H23AG), (PEANUT-REACTIVE URINARY MUCIN), (PUM), (BREAST CARCINOMA- ASSOCIATED ANTIGEN DF3) 5. CTCL tumor antigen se1-1 6. CTCL tumor antigen se14-3 7. CTCL tumor antigen se20-4 8. CTCL tumor antigen se20-9 9. CTCL tumor antigen se33-1 10. CTCL tumor antigen se37-2 11. CTCL tumor antigen se57-1 12. CTCL tumor antigen se89-1 13. Prostate-specific membrane antigen 14. 5T4 oncofetal trophoblast glycoprotein 15. Orf73 Kaposi's sarcoma-associated herpesvirus 16. MAGE-C1 (cancer/testis antigen CT7) 17. MAGE-B1 ANTIGEN (MAGE-XP ANTIGEN) (DAM10) 18. MAGE-B2 ANTIGEN (DAM6) 19. MAGE-2 ANTIGEN 20. MAGE-4a antigen 21. MAGE-4b antigen 22. Colon cancer antigen NY-CO-45 23. Lung cancer antigen NY-LU-12 variant A 24. Cancer associated surface antigen 25. Adenocarcinoma antigen ART1 26. Paraneoplastic associated brain-testis-cancer antigen (onconeuronal antigen MA2; paraneoplastic neuronal antigen) 27. Neuro-oncological ventral antigen 2 (NOVA2) 28. Hepatocellular carcinoma antigen gene 520 29. TUMOR-ASSOCIATED ANTIGEN CO-029 30. Tumor-associated antigen MAGE-X2 31. Synovial sarcoma, X breakpoint 2 32. Squamous cell carcinoma antigen recognized by T cell 33. Serologically defined colon cancer antigen 1 34. Serologically defined breast cancer antigen NY-BR-15 35. Serologically defined breast cancer antigen NY-BR-16 36. Shromogranin A; parathyroid secretory protein 1 37. DUPAN-2 38. CA 19-9 39. CA 72-4 40. CA 195 |
Гликопротеины, входящие в состав вакцины, имитируют от 6 до 50 фрагментов (длиной 7-30 аминокислотных остатков) каждого из указанных опухолевых антигенов.
Информационные источники
1.Nagle R. B. et al. Phenotypic relationships of prostatic intraepithelial neoplasia to invasive prostatic carcinoma. / Am. J. Pathol. 1991, 138 (1), 119-128.
2.Hsia C. C. et al. Occurence of oval-type cells in hepatitis B virus-associated human hepatocarcinogenesis. / Hepatology 1992, 16 (6), 1327-1333.
3.Thorgeirssen S. S. Target cell populations in virus-associated hepatocarcinogenesis. / Princess Tagamatsu Symp. 1995, 25, 163-170.
4.Van Eyken P. et al. Immunocytochemistry of cytokeratins in primary human liver tumors. / APMIS Suppl. 1991, 23, 77-85.
5.Van Noorden C. J. et al. Ectopic mineralized cartilage formation in human undifferentiated pancreatic adenocarcinoma explants grown in nude mice. / Calcif. Tissue Int. 1995, 56 (2), 145-153.
6.Thorban S. et al. Epithelial tumour cells in bone marrow of patients with pancreatic carcinoma detected by immunocytochemical staining. / Eur. J. Cancer 1996, 32A (2), 363-365.
7.Pantel K. et al. Establishment of micrometastatic carcinoma cell lines: a novel source of tumor cell vaccines. / J. Natl. Cancer Inst. 1995, 87 (15), 1162-1168.
8.Kruger W. et al. Reverse transcriptase/polymerase chain reaction detection of cytokeratin-19 mRNA in bone marrow and blood of breast cancer patients. / J. Cancer Res. Clin. Oncol. 1996, 122 (11), 679-686.
9.Ethier S. P. et al. Differential isolation of normal luminal mammary epithelial cells and breast cancer cells from primary and metastatic sites using selective media. / Cancer Res. 1993, 53 (3), 627-635.
10.Gorai I. et al. Establishment and characterization of two human ovarian clear cell adenocarcinoma lines from metastatic lesions with different properties. / Gynecol. Oncol. 1995, 57 (1), 33-46.
11.Mobus V. et al. Morphological, immunohistochemical and biochemical characterization of 6 newly established human ovarian carcinoma cell lines. / Int. J. Cancer 1992, 52 (1), 76-84.
12.Kooy A. J. W. et al. Expression of cytokeratin 8 and low molecular weight cytokeratins in human basal cell carcinoma. / Anticancer Res. 1995, 15, 241-248.
13.Raphael S. J. et al. Brief report: detection of high-molecular-weight cytokeratins in neoplastic and non-neoplastic thyroid tumors using microwave antigen retrieval. / Modern Pathol. 1995, 8 (8), 870-872.
14.Braun S. & Pantel K. Immunodiagnosis and immunotherapy of isolated tumor cells disseminated to bone marrow of patients with colorectal cancer. / Tumori 1995, 81 (Suppl.), 78-83.
15.Doweck I. et al. CYRFA 21-1. A new potential tumor marker for squamous cell carcinoma of head and neck. / Arch. Otolaryngol. Head Surg 1995. 121, 177-181.
16.Gould V. E. et al. Increased numbers of cytokeratin-positive interstitial reticulum cells (CIRC) in reactive, inflammatory and eoplastic lymphadenopathies: hyperplasia or induced expression. / Virch. Arch. 1995, 425, 617-629.
17.Muraki M. et al. Assessment of serum CYFRA 21-1 in lung cancer. / Cancer 1996, 77, 1274-1277.
18.Niklinski J. et al. Diagnostic and prognostic value of the new tumour marker CYRFA 21-1 in patients with squamous cell lung cancer. / Eur. Respir. J. 1995, 8, 291-294.
19.Trevisani L. et al. Cytokeratin tumor marker levels in bronchial washing in the diagnosis of lung cancer. / Chest 1996, 109, 104-108.
20.Molina R. et al. Study of a new tumor marker, CYRFA 21-1, in malignant and nonmalignant diseases. / Tumor Biol. 1994, 15, 318-325.
21.Behbehani A.I., Mathew A., Farghaly M., A.Van Dalen. Reference levels of the tumor markers carcinoembryonic antigen, the carbohydrate antigens 19-9 and 72-4, and cytokeratin fragment 19 using the ®Elecsys Relecsys 1010 analyzer in a normal population in Kuwait. The importance of the determination of local reference levels. / The International Journal of Biological Markers, 2002, Vol. 17 (1), 67-70.
22.Identification of a human telomerase reverse transcriptase peptide of low affinity for HLA A2.1 that induces cytotoxic T lymphocytes and mediates lysis of tumor cells.
Hernandez J., Garcia-Pons F., Lone Y.C., Firat H., Schmidt J.D., Langlade-Demoyen P., Zanetti M. / Proc Natl Acad Sci USA 2002 Sep17; 99(19): 12275-80. / Department of Medicine and Cancer Center, University of California at San Diego, 9500 Gilman Drive, La Jolla, CA 92093-0837, USA.
23.Tumour immunotherapy: new tools, new treatment modalities and new T-cell antigens.
Schultze J.L., Maecker B., Von Bergwelt-Baildon M.S., Anderson K.S., Vonderheide R.H. / Vox Sang 2001 Feb; 80(2):81-9. / Department of Adult Oncology, Dana-Farber Cancer Institute, 44 Binney Street, D540C, Boston, MA 02115, USA
24.Induction of cytotoxic T cell responses and tumor immunity against unrelated tumors using telomerase reverse transcriptase RNA transfected dendritic cells.
Nair S.K., Heiser A., Boczkowski D., Majumdar A., Naoe M., Lebkowski J.S., Vieweg J., Gilboa E. / Department of Surgery, Center for Genetic and Cellular Therapies, Duke University Medical Center, Durham, NC 27710, USA.
25.Cytotoxic T cell immunity against telomerase reverse transcriptase in humans.
Minev B., Hipp J., Firat H., Schmidt J.D., Langlade-Demoyen P., Zanetti M. / Proc Natl Acad Sci USA 2000 Apr 25; 97(9): 4796-801. / Departments of Medicine and Cancer Center, University of California, San Diego, 9500 Gilman Drive, La Jolla, CA 92093-0368, USA.